Reversão da vasectomia
Homens que recorreram à vasectomia para garantir que não tenham mais filhos e que por diferentes circunstâncias desejam restaurar a fertilidade podem se submeter à reversão da vasectomia. O procedimento registra taxas de sucesso em boa parte dos casos.
Por ser um processo mais complexo que o de vasectomia, a reversão depende de algumas variáveis, como o tempo decorrido da cirurgia: quanto menor, maiores as chances de gravidez.
No entanto, nos casos em que a reversão não é possível ou quando o procedimento não é bem-sucedido, os espermatozoides podem ser recuperados do epidídimo ou dos testículos, a partir do tratamento por FIV (fertilização in vitro) com injeção intracitoplasmática de espermatozoides (ICSI), que registra taxas bastantes expressivas de sucesso gestacional.
Este texto explica a reversão da vasectomia, destacando as técnicas utilizadas para realizar o procedimento e para a recuperação de espermatozoides pelo tratamento de FIV com ICSI.
Como a reversão da vasectomia é realizada?
Em um processo natural, os espermatozoides são produzidos nos túbulos seminíferos, localizados nos testículos, e armazenados no epidídimo, duto que os nutre até ganharem maior motilidade para serem transportados pelo duto deferente e ejaculados.
Para assegurar que a fecundação não ocorra, o transporte dos espermatozoides pelo duto deferente é interrompido na vasectomia. Ou seja, os gametas masculinos continuam a ser produzidos, porém permanecem armazenados no epidídimo e não estão presentes no sêmen ejaculado.
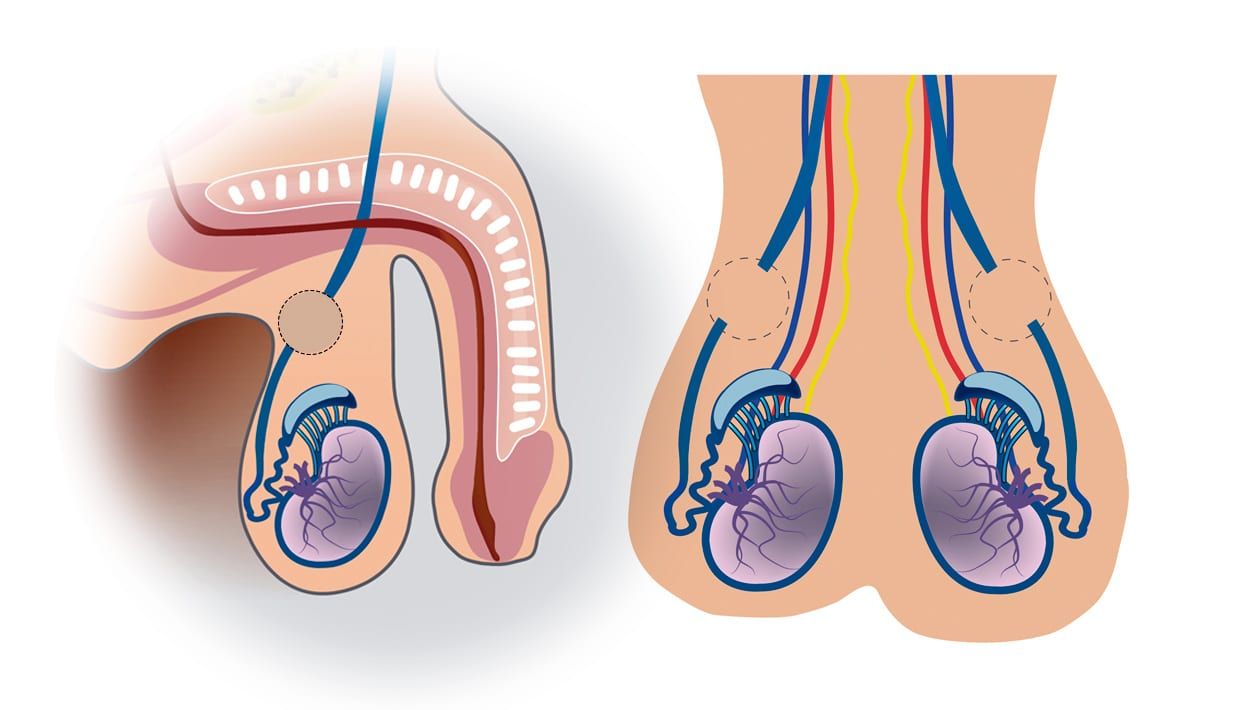
A cirurgia para a reversão da vasectomia prevê a reconexão das partes do duto deferente que foram separadas ou a conexão das extremidades ao epidídimo, de acordo com cada caso. É realizada por duas técnicas minimamente invasivas, vasovasostomia ou vasoepididimostomia, com ou sem o auxílio de um robô (cirurgia robótica), em ambiente hospitalar, com anestesia geral ou local.
Os testículos são expostos a partir de uma incisão na bolsa testicular. A vasovasostomia prevê a reconexão das extremidades anteriormente cortadas, permitindo a passagem dos espermatozoides. Por isso, é indicada quando há presença de espermatozoides no fluido seminal armazenado nos dutos deferentes.
Já a vasoepididimostomia é o procedimento mais adequado quando um tecido cicatricial resultante da vasectomia bloqueia o fluxo dos gametas. Para contornar o bloqueio, os dutos deferentes são diretamente conectados ao epidídimo.
Cada procedimento pode ser realizado em um testículo diferente.
Embora a reversão da vasectomia raramente provoque complicações, pode ocorrer sangramento no interior da bolsa, resultando em hematoma, inchaço e dor testicular, ou infecção, geralmente sinalizada por febre alta.
A rotina normal pode ser retomada após uma semana, e a relação sexual cerca de três semanas depois. O uso de um suporte atlético é indicado durante o período de recuperação.
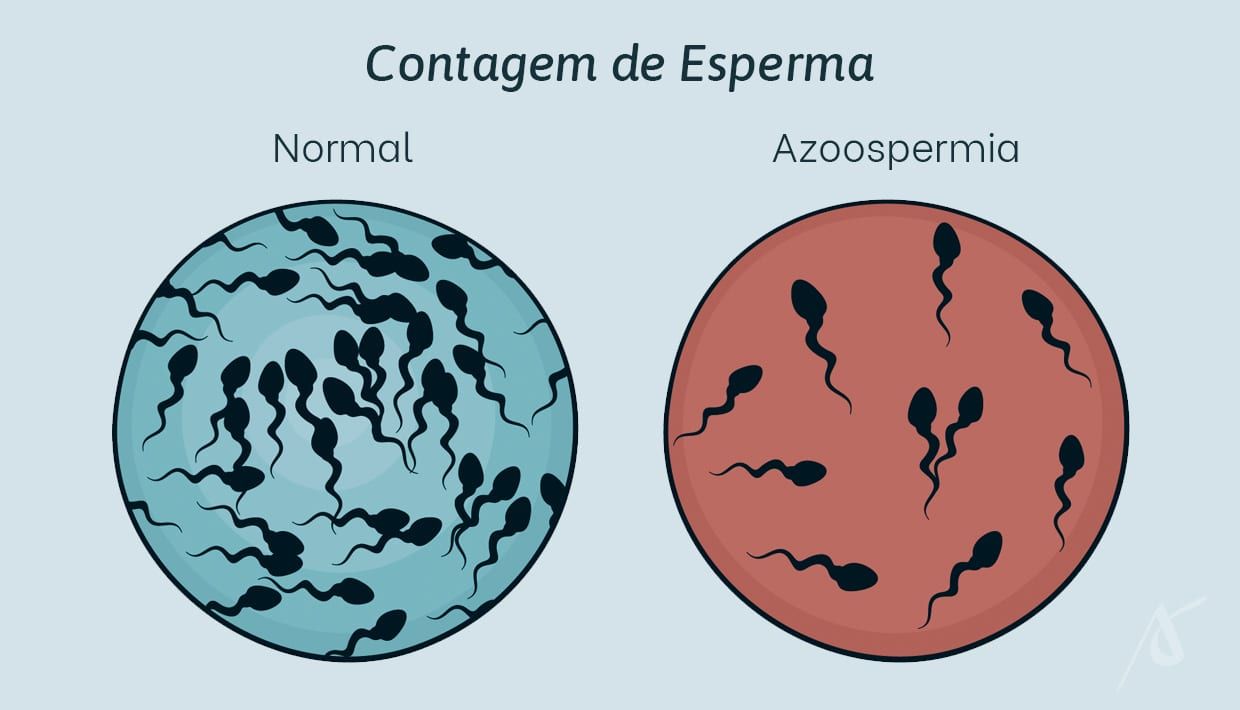
Para confirmar se a cirurgia foi bem-sucedida, o espermograma, exame padrão que avalia a fertilidade masculina, deve ser realizado periodicamente. Os espermatozoides tendem a estar novamente presentes no sêmen ejaculado entre quatro meses e um ano.
No entanto, mesmo que a cirurgia seja bem-sucedida, nem sempre a gravidez ocorre. Quando isso acontece, o tratamento de FIV com ICSI passa a ser a principal indicação.
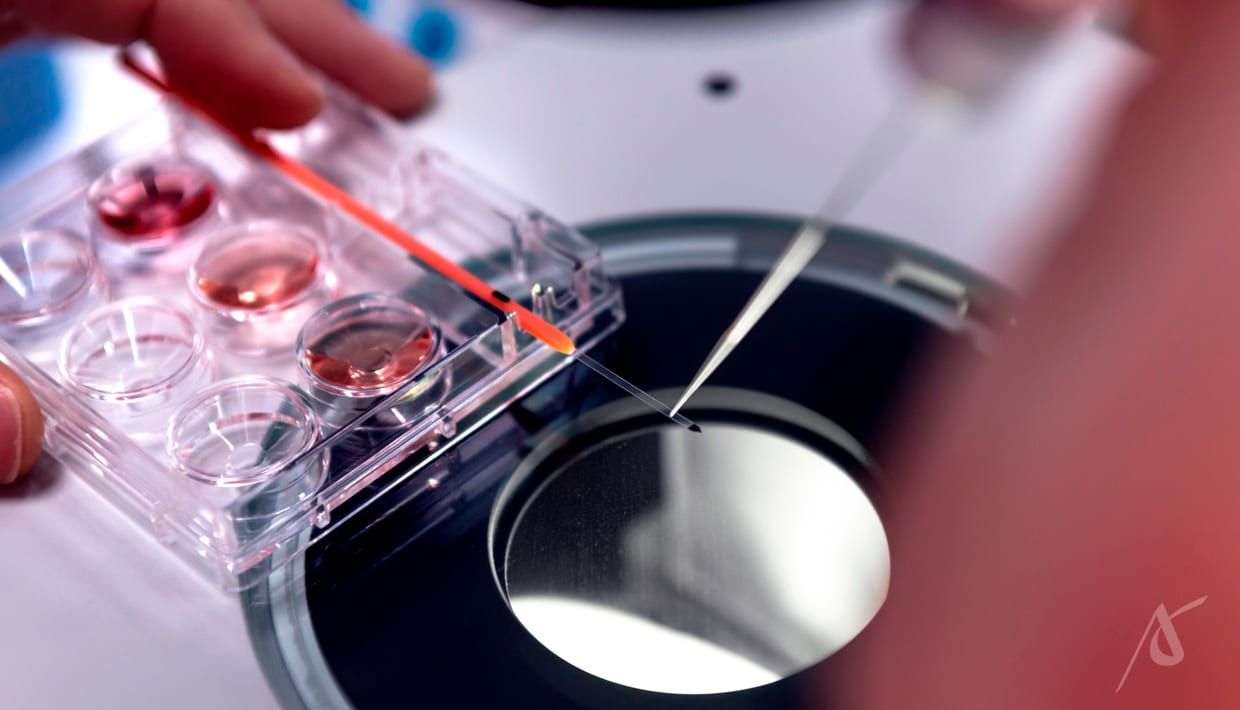
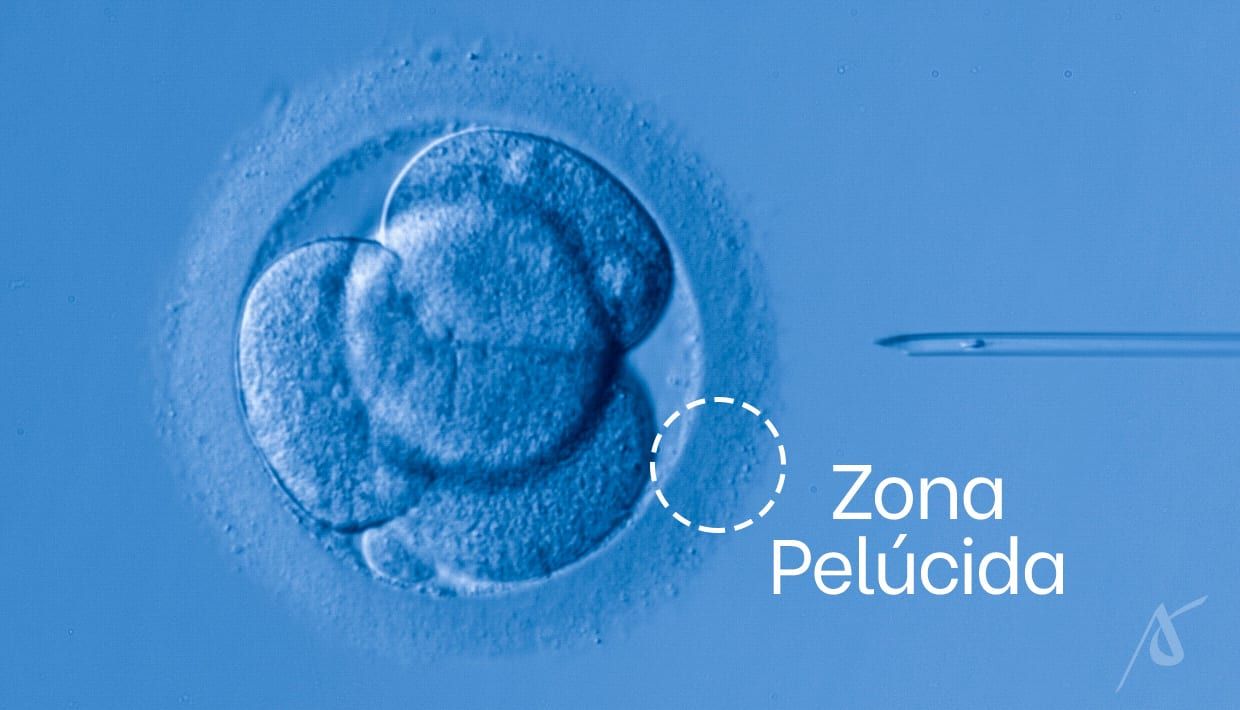
Na FIV com ICSI, os espermatozoides podem ser recuperados do epidídimo ou dos testículos. A recuperação do epidídimo é feita a partir de duas técnicas: PESA e MESA. Já para recuperá-los dos testículos, são utilizadas as técnicas TESE e Micro-TESE, nas quais os espermatozoides são extraídos por biópsia do tecido testicular.
Após a recuperação, os espermatozoides com melhor morfologia e motilidade são selecionados pelo preparo seminal, técnica complementar à FIV. No momento da fecundação, cada um é individualmente injetado no óvulo.
A FIV com ICSI permitiu o tratamento de infertilidade masculina por fatores graves e aumentou as taxas de sucesso.
Além disso, a FIV é atualmente considerada a principal técnica de reprodução assistida e a que apresenta os percentuais mais expressivos de gravidez bem-sucedida por ciclo de realização.